Pengolongan sel elektrokimia antara lain:
A. Sel galvani/ sel volta
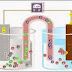
Sel Volta atau sel galvani adalah sel elektrokimia yang melibatkan raksi redoks dan menghasilkan arus listrik.Sel volta terdiri atas elektroda tempat berlangsungnya reaksi oksidasi disebut anoda (electrode negative) , dan tempat berlangsungnya reaksi reduksi disebut katoda(electrode positif). Susunan sel volta adalah :
Notasi sel : Y / ion Y // ion X / X
Logam X mempunyai potensial reduksi yang lebih positip dibanding logam Y , sehingga logam Y bertindak sebagai anoda dan logam X bertindak sebagai katoda.
Jembatan garam mengandung ion-ion positif dan ion-ion negatif yang berfungsi menetralkan muatan positif dan negative dalam larutan elektrolit. Salah satu aplikasi sel galvani adalah penggunaan sel Zn/Ag2O3 untuk baterai jam.
B. Sel elektrolisis
Sel elektrolisis adalah sel yang menggunakan arus listrik. Pada sel elektrolisis, reaksi kimia tidak terjadi secara spontan tetapi melalui perbedaan potensial yang dipicu dari luar sistem. Anoda berfungsi sebagai elektroda bermuatan positif dan katoda bermuatan negatif, sehingga arus listrik mengalir dari anoda ke katoda. Sel elektrolisis banyak digunakan untuk produksi alumunium atau pemurnian tembaga.





0 komentar:
Posting Komentar